Ожог – распространенное повреждение, которое можно получить в быту или на производстве. Обжечь кожу можно кипящей жидкостью или паром, раскаленными предметами и частицами расплавленного металла, агрессивными едкими кислотами, щелочами и прочими химическими реагентами. Также к повреждению кожного покрова приводит удар электрического тока и воздействие вредного ионизирующего излучения. При небольших и неглубоких ожогах проводится консервативное лечение. Если же площадь повреждения обширна, а повреждение затрагивает глубокие кожные структуры, единственным действенным методом лечения становится пересадка кожи после ожога.
Степени ожога
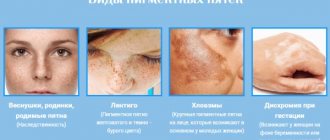
По глубине повреждения тканей ожоги классифицируют на 4 степени.
- Повреждение поверхностного слоя (эпидермиса), сопровождающееся болезненностью, покраснением и небольшим отеком обожженного участка. Заживает за несколько дней без специального лечения.
- Повреждение эпидермиса и верхнего слоя дермы, проявляющееся сильной болью, отеком, покраснением, образованием пузырей, заполненных прозрачной серозной жидкостью. При грамотной медикаментозной терапии травма заживает за 10-14 дней.
- Ожог 3 степени классифицируется на 2 вида. Степень 3А характеризуется повреждением эпидермиса и дермы, образованием крупных волдырей с мутной жидкостью внутри, струпа (корки) на обожженной поверхности. Степень 3Б диагностируется при поражении всех кожных слоев и частичном повреждении подкожной жировой клетчатки. Образующиеся пузыри заполнены кровянистой жидкостью.
- Самая тяжелая травма, сопровождающаяся обугливанием кожи, мышечной и костной ткани, полной утратой чувствительности из-за разрушения нервных волокон.
Даже маленький по размерам, но очень глубокий ожог опасен проникновением инфекции, ее распространением через кровеносное русло по всему организму. Результатами могут стать сепсис, летальный исход.
Колхури
Этот противовоспалительный препарат выпускает грузинская фармакологическая . Представляет собой мазь с приятным травяным ароматом. Колхури разработана на растительной основе и обладает очень широким спектром действия. В том числе ее применяют и для лечения ожогов.
мазь Колхури
Колхури обладает следующими свойствами:
- противоспалительным;
- антисептическим;
- обезболивающим;
- регенеративным;
- иммуностимулирующим.
Подобный препарат не имеет противопоказаний за исключением одного – индивидуальной непереносимости компонентов, входящих в его состав. Хорошо зарекомендовал себя при лечении проблем с суставами, подагре, миалгии и ряде других заболеваний.
Показания к пересадке
Операция по пересадке кожи называется дермопластикой (иначе кожной пластикой, трансплантацией), назначается в ситуациях, когда восстановить обожженные ткани другими способами невозможно.
Обязательными показаниями к дермопластике являются:
- 3Б и 4 степень ожога с площадью поражения более 2,5 см;
- ожоги 2-3 степени при обширной площади повреждения;
- образование грубой рубцовой ткани, сильные кожные дефекты;
- трофические язвы на обожженном участке.
Ожоги 2 и 3А степени являются пограничными, обычно лечатся консервативно. Реже для ускорения регенерации и предупреждения осложнений врач может порекомендовать провести пересадку кожи.
При глубоких ожогах, занимающих большую площадь, операцию нельзя проводить до образования на раневой поверхности молодой грануляционной соединительной ткани, поэтому пересадка осуществляется не раньше, чем через 20-30 дней после травмы. При маленьких ранах с ровными краями и отсутствии участков некроза пластику разрешается выполнять в течение первой недели после травмы.
У детей
Особенно тяжелые ожоговые повреждения кожи диагностируются у детей – по данным статистики, дермопластику перенесли более половины пострадавших детского возраста. Пересадка кожи после ожога у детей производится обязательно, в ином случае происходит:
- формирование грубых рубцов, стяжений, заметных кожных дефектов, вызывающих функциональные нарушения, физический дискомфорт и психологические расстройства;
- неправильное формирование опорно-двигательного аппарата (из-за неравномерного растяжения здоровых и рубцовых тканей сухожилия и мышечные волокна перекручиваются).
Особенности ухода и реабилитации после трансплантации
Период восстановления можно разделить на 3 периода. Первый — через 2-3 дня после процедуры, когда кожа подстраивается под себя. Второй этап — регенерация, которая занимает 2-2,5 месяца. В этот период следует защитить участок с пересаженной кожей от разного рода повреждений. Повязка снимается только с согласия врача.
Уход за раной — важная часть послеоперационного ухода. Процедура проводится только в клинике с использованием стерильных материалов. Для лечения в домашних условиях врач прописывает обезболивающие, а также используют специальные мази для поддержания водного баланса в ране. Главное, не допускать высыхания кожи в месте пересадки, иначе будет ощущаться сильный зуд. Рекомендации, которые дает врач перед выпиской, следующие:
- Своевременная смена повязки;
- постельный режим;
- Не мочите рану;
- Питьевой;
- отказ от алкоголя;
- прием витаминов;
- Правильное питание.
Третий этап выздоровления — реабилитация. Для полного выздоровления требуется 3 месяца. При соблюдении всех указаний врача период восстановления проходит быстро и без видимых осложнений. После этого человек сможет вернуться к своему обычному образу жизни.
Противопоказания
Противопоказаниями к проведению дермопластики являются:
- отсутствие молодой соединительной (грануляционной) ткани при обширном повреждении;
- участки некроза на ране;
- воспаление на пораженных и близлежащих здоровых участках;
- выделение серозного или гнойного экссудата;
- множественные кровоизлияния, скопление жидкой или свернувшейся крови в мягких тканях (гематома).
К относительным противопоказаниям относят неудовлетворительное физическое состояние пациента:
- ожоговый шок;
- потерю большого объема крови;
- истощение;
- низкий гемоглобин и плохие показатели других лабораторных исследований.
Ируксол
Мазь предназначена для лечения ран различного происхождения, включая ожоги I-III степени. Ее производитель – Smith Nephew (Германия). Основные действующие вещества – хлорамфеникол и клостридиопептидаза.
мазь Ируксол
Препарат воздействует на пораженную зону сразу в нескольких направлениях:
- очищает ожог от загрязнений;
- рассасывает отмершие клетки, ткани, гной и струпья;
- уничтожает бактерии и патогенные микроорганизмы;
- стимулируя процесс грануляции способствует более быстрому заживлению ран.
По мнению врачей и пациентов Ируксол – это очень хорошая мазь после ожогов, поскольку она воздействует комплексно, но при этом избирательно (не повреждает живую ткань). Препарат стимулирует микроциркуляцию крови, не провоцируя при этом кровотечения. Он ускоряет регенерацию кожного покрова и обладает свойством рассасывать рубцы.
Подготовка к дермопластике
Первичная дермопластика проводится через 3-4 дня после ожога при небольшой площади раны, не требует подготовительных мероприятий.
Но чаще осуществляется вторичная (спустя 20-30 дней после получения травмы) пересадка кожи после ожога. В этом случае обязательна подготовка раны к хирургическому вмешательству: механическое очищение и медикаментозная терапия, направленная на удаление гнойного и некротического содержимого, предупреждение или лечение уже возникших инфекционных осложнений. Также проводятся мероприятия, направленные на стабилизацию и улучшение общего физического состояния пациента.
Этап подготовки включает:
- назначение витаминных и общеукрепляющих средств (для повышения сопротивляемости организма);
- системную антибактериальную терапию;
- применение местных антисептиков и антибактериальных препаратов (накладывание мазей под повязку прекращают за 3-4 дня до намеченной даты трансплантации, поскольку оставшиеся частицы лекарственных средств могут осложнять приживление трансплантата);
- антисептические ванны с раствором перманганата калия или фурацилина;
- УФ-облучение раневой поверхности;
- гемотрансфузию (переливание крови) или трансфузию плазмы (проводятся по показаниям).
Результаты исследований последних лет в области биохимии, патофизиологии, иммунологии объяснили некоторые, ранее неизвестные, молекулярно-клеточные механизмы хронизации ран различной этиологии, в том числе сопровождающих ряд распространенных и редких дерматозов, а стимул в поисках новых, более эффективных методов их лечения до сих пор не ослабевает. К числу методов лечебного воздействия, предложенных относительно недавно, относятся клеточные технологии и создание эквивалентов кожи.
Первые попытки применения клеточных технологий в лечении ран различной этиологии, а также ожогов, были предприняты в середине XX века. С тех пор было предложено множество различных клеточных технологий, в том числе: выращивание in vitro
клеток кожи (кератиноциты, фибробласты), нанесение суспензии, состоящей из аутоклеток, на рану, тканеинженерные конструкции («живой дермальный эквивалент», «живой эквивалент кожи»), а также биосинтетические покрытия, имитирующие кожу [1, 2].
Впервые принципиальная возможность выращивания клеток кожи, в частности, кератиноцитов in vitro
, была показана в 1948 г. в работе P. Medawar [3, 4], что положило начало новому направлению в создании биологических покрытий.
В 1977 г. Г. Грин и соавт. [5, 6] разработали метод культивирования клеток кожи и получения эпителиальных пластов большой площади, что позволило использовать их на практике.
Первую успешную трансплантацию аутологичных кератиноцитов из первичной культуры на раны кроликов осуществил в 1971 г. M. Karasek [7, 8]. В дальнейшем для получения кератиноцитов стали использовать различные подложки из биологических тканей (в частности из кожи свиньи), что позволило улучшить выход клеток при каждом пассаже [9, 10].
В 1975 г. Rheinwald и H. Green [11, 12] разработали технологию серийного культивирования больших количеств кератиноцитов человека и успешно применили ее в комбустиологии.
В настоящее время доказано, что трансплантация кератиноцитов кожи человека способствует закрытию эпидермисом ожоговых ран и ран иного происхождения различной площади [13—15]. Однако культивирование аутокератиноцитов занимает длительный период времени (3—4 нед). За это время рана инфицируется и приживления клеток не происходит. Кроме того, использование аутокератиноцитов делает невозможным создание банка клеточных трансплантатов: обязательным элементом получения значительных объемов кератиноцитов является использование многочисленных дорогостоящих биологических стимуляторов роста эпидермальных клеток, что значительно увеличивает стоимость получаемого материала и ограничивает сроки его хранения [2, 16].
В 90-е годы ХХ века в Институте хирургии им. А.В. Вишневского РАМН Д.С. Саркисовым и соавт. [17, 18] был разработан оригинальный и эффективный способ лечения ожоговых ран на основе применения культивированных клеток, принципиально отличавшийся тем, что в качестве основного компонента культивированного пласта клеток были впервые использованы не кератиноциты, а фибробласты. Фибробласты представляют собой гетерогенную популяцию клеток мезенхимного ряда и играют ключевую роль в процессах регуляции клеточных взаимодействий и поддержании гомеостаза кожи. Фибробласты не только формируют оптимальные условия для функционирования и пролиферации других типов клеток (эпителиальные, эндотелиальные, клетки волосяных фолликулов), но и отвечают за координацию их функций в соответствии с расположением на теле. Результаты исследований Д.С. Саркисова и соавт. [18, 19] предопределили возможность использования фибробластов как основного элемента клеточного трансплантата в лечении ран различной этиологии. Способность фибробластов формировать межклеточный матрикс, синтезировать цитокины, вызывать миграцию и пролиферацию разных типов клеток при повреждениях кожи сделала их перспективными для широкого клинического применения [20].
Полученные к настоящему времени результаты исследований показали, что при применении культивированных аллофибробластов сокращается потребность в ресурсах донорской кожи, обеспечивается быстрая эпителизация раневой поверхности и своевременное восстановление целостности кожного покрова [17, 21—23]. Однако этот метод имеет ряд недостатков. Для выращивания аллофибробластов необходимо 3—4 дня; пересадка аллоклеток может спровоцировать сенсибилизацию организма чужеродными антигенами; нельзя гарантировать отсутствие у донора тяжелых инфекционных заболеваний. Следует также учитывать, что недостатки в финансировании сферы здравоохранения, а также в правовом регулировании на территории России в свое время ограничили возможность внедрения данной технологии в клиническую практику [2].
В начале 50-х годов XX века R. Billingham и J. Reynolds [24, 25] предприняли попытку использовать для лечения ран аутологичные клетки эпидермиса. При этом кератиноциты не культивировали, а лишь отделяли эпидермис от дермы с помощью фермента трипсина и получали клеточную суспензию эпидермоцитов, которую переносили на подготовленное ложе раны. Такого рода трансплантация приводила к появлению островков эпителизации в ране, которые затем сливались между собой.
В 1993 г. F. Wood и соавт. [26] разработали и запатентовали так называемый spray on skin
— способ получения аутокератиноцитов и их трансплантации в виде суспензии и распыления на раневые поверхности, в том числе на большие по площади. Позже в Великобритании с учетом клинических разработок F. Wood компанией Avita Medical Ltd. [27] была создана ReCell — технология, позволяющая за короткий промежуток времени (20—30 мин) получать клеточную суспензию, состоящую из аутологичных кератиноцитов и меланоцитов. Для приготовления клеточной суспензии был необходим «кит» для сбора аутологичных клеток. С донорского участка кожи при помощи дерматома получали биоптат толщиной 0,2—0,3 мм, размером 1×1 или 2×2 см, в зависимости от площади поражения. Готовили раствор фермента трипсина, который впрыскивали в стеклянный флакон рабочего устройства для подогрева. Биопсийный материал помещали в раствор трипсина на 15—20 мин. Затем отделяли эпидермальный слой от дермального. С поверхности дермального слоя скальпелем проводили соскоб аутоклеток. Для приготовления суспензии клетки разводили лактатом натрия. Полученную клеточную суспензию очищали в клеточном фильтре. Отфильтрованную суспензию аутоклеток наносили на рану капельно или в виде спрея.
Другим направлением тканевой инженерии кожи стало использование аутофибробластов [28]. Для создания 1,5 см2 аутоткани необходим кожный биоптат площадью 3 мм2, при этом сроки культивации максимально малого количества донорского материала составляют в среднем 3 нед [29, 30]. На первом этапе культивирования получают первичную культуру фибробластов путем фрагментирования и ферментативной обработки дермы раствором трипсина. Культивирование клеток осуществляют в питательной среде Игла (DMEM) c добавлением 10% телячьей эмбриональной сыворотки. Далее первичную культуру пассируют, подвергая 4—7-кратному субкультивированию [30]. Субкультивирование проводят на мембране, с помощью которой культура трансплантируется в рану. Контроль контаминации культуры бактериями, микоплазмами и вирусами осуществляют микробиологическими и цитогенетическими методами на первых пассажах и при создании банков культур клеток. Аттестацию культур клеток на стабильность кариотипа, туморогенность проводят в соответствии с требованиями ВОЗ [30, 31].
Новым этапом развития биоинженерных технологий в лечении длительно незаживающих ран стали создание и использование «живого эквивалента кожи», который представляет собой коллагеновый гель, содержащий микроносители алло- или аутофибробластов и покрытый культурой аллокератиноцитов [32—36]. «Живой эквивалент дермы» имеет сходство с тканью. Его основой является коллагеновый гель, заселенный фибробластами, а на поверхности геля выращены кератиноциты [37]. Создание данного материала представляет собой трудоемкий процесс, выполняемый в специальных лабораториях, требует разработки технологии забора и культивирования клеток, создания банка культур клеток, а также внедрения системы контроля качества.
Одним из современных направлений в создании живых эквивалентов кожи является применение для культивирования стволовых, в частности мезенхимальных (MSCs), а также амниотических эпителиальных клеток человека (hAECs), которые вместе с фибробластами способны воссоздавать in vitro
структуру кожи и базальной мембраны [38—41]. Проводятся исследования, направленные на повышение регенеративных способностей и усиление васкуляризации в коммерчески доступных эквивалентах кожи путем применения активированных стволовых клеток, полученных из человеческой кожи (SDSC) [42]. Отмечено применение для создания искусственной кожи трехмерной (3D) печати (3D-биопринтинга), которая является важной составляющей регенеративной медицины, призванной удовлетворить потребность в тканях и органах, пригодных для трансплантации [43].
Одним из важных вопросов клеточной медицины является перенос культивируемых in vitro
клеток в организм человека. Поскольку клеточные культуры субстратзависимы и растут прикрепленными к культуральному пластику, возникает необходимость ферментативной обработки клеток и их перевода в суспензию перед трансплантацией, о чем говорилось выше (технология ReCell). В результате подобных манипуляций жизнеспособность клеток значительно снижается, что, безусловно, влияет на качество трансплантации. Использование в качестве подложек различных биопластических материалов позволило избежать этих проблем, так как по сравнению с суспензионными клеточными трансплантатами они повышают выживаемость клеток, обеспечивают их более активную пролиферацию за счет адгезии на матриксе; выступают в качестве объемообразующего агента, способствуют активной индукции ангиогенеза и репаративной регенерации [44].
В качестве структурной основы для тканеинженерных конструкций, в том числе в живых тканевых эквивалентах кожи, в настоящее время используются различные материалы на основе свиной дермы [45], амниотической оболочки [46], подслизистой оболочки мочевого пузыря [47], синтетических биодеградируемых и небиодеградируемых материалов [48, 49], а также коллагенового геля, который начали использовать одним из первых [37].
В целях оптимизации структуры и функций подложек в настоящее время проводятся работы по конструированию двухмерных (2D) и 3D-матриксов для тканеинженерных конструкций, в том числе 3-слойных «сэндвич»-коллагеновых каркасов с различными размерами пор, имитирующих природные структуры человеческой кожи [50]. Проводятся исследования по изучению влияния различных биоматериалов, используемых в качестве каркасов (например хитозан, желатин, фибрин, бычий коллаген, свиная дерма, коллаген-глюкозамигногликана, наноматериалы), на ключевые параметры культивирования клеток (эффективность высева, клеточное распределение, выживаемость, метаболическая активность) [51—55].
Виды искусственной кожи
В настоящее время существует много различных классификаций заменителей кожи (Jones и соавт., 2002; Atiyeh и соавт., 2005; Horch и соавт., 2005; Atiyeh & Costagliola, 2007; Кларк и соавт., 2007; Макнейл, 2007; Patel & Fisher, 2008) [56]. Подробное освещение классификации, а также практических и теоретических аспектов создания и применения тканеинженерных конструктов кожи и перспектив использования искусственной кожи в клинической практике содержится в обзорах [2, 20, 56, 57].
По типу биоматериала заменители кожи подразделяются на биологические (в том числе аутологичные, аллогенные, ксеногенные) и синтетические (биоразлагаемые и не поддающиеся биохимическому разложению).
Аутологичная кожа — кожа, получаемая от самого больного (как правило, речь идет о пациенте с ожогом той или иной степени тяжести), с последующим временным закрытием раневых поверхностей. Аутологичную кожу получают путем повторного срезания кожи с одних и тех же донорских участков пациента и с областей тела, где завершилась эпителизация поверхностных ожоговых ран. Особенно ценным донорским участком для срезания расщепленных лоскутов кожи является волосистая часть головы (скальп). Из-за большого количества придатков кожи (волосяных фолликулов и сальных желез) и хорошего кровоснабжения эпителизация ран происходит быстро. С волосистой части головы расщепленную кожу можно срезать многократно (до 7 раз и более) [58]. Из-за недостаточных ресурсов собственной кожи у тяжело обожженных быстро восстановить кожный покров традиционными методами аутодермопластики не удается. По этой причине совершенствование методов экономной кожной пластики остается актуальным.
Аллогенная кожа человека (трупная или полученная от живого донора) является «золотым стандартом» раневого покрытия [59]. При ее пересадке достигается физиологическая окклюзия ран; она препятствует проникновению микроорганизмов в раны и способствует эпителизации донорских ран и ожогов IIIа степени. При использовании аллогенных тканей снижается потребность в аутологичной коже при оперативном восстановлении кожного покрова. Как правило, кожу получают от трупов с небольшими сроками (не более 6 ч) после наступления смерти. Для закрытия ран и комбинированной пластики может использоваться трупная кожа, консервация и хранение которой осуществлялись различными способами. Как правило, процедура консервации ухудшает биологические свойства кожи, поэтому лучше применять так называемую свежую кожу с небольшими сроками хранения. Вместе с тем аллогенная кожа является мощным аллергеном и вызывает выраженную сенсибилизацию организма. Это иногда приводит к расплавлению ранее приживших лоскутов, аутокожи, в том числе на фоне иммунодепрессивной терапии.
Ксенокожа — медицинский заменитель кожи. Ксенокожу чаще всего получают из кожи свиньи. Применяется в медицине в основном при лечении ожоговых больных. При производстве ксенокожи срезают слой свиной кожи толщиной 0,3—0,4 мм, потом консервируют в азоте, высушивают и фасуют в стерильные пакеты по 100, 200 или 300 см². Кожа в таком пакете может храниться до 3 лет. Ксенокожу перед использованием размачивают в физрастворе или антисептике, накладывают на рану и фиксируют специальными повязками. В большинстве случаев при применении данного материала через 1—2 нед ксенокожа на ране подсыхает и отпадает. Вместо нее образуется нормальная человеческая кожа. Достоинством ксенокожи является то, что под ней редко наступает нагноение, что улучшает заживление ожогов и других обширных ран. Стоимость этого продукта в большинстве случаев весьма умеренная, что делает его доступным в развивающихся странах. Применение ксенокожи целесообразно, когда поражено свыше 50% кожи пострадавшего. Однако кожа животного вызывает у некоторых людей выраженные иммунные реакции. За отторжение ответственен фрагмент α-1,3-галактозы (Gal), присутствующий на мембранах свиных клеток, антитела к которым присутствуют в крови людей. С целью решения данной проблемы в последнее время ведутся исследования возможности применения кожи низкоиммуногенных свиней, в которых не экспрессируется эпитоп Gal, из-за селективного нокаута гена, кодирующего α-1,3-галактозилтрансферазу. Применение трансплантатов из кожи низкоиммуногенных свиней для временного заживления ожоговых ран на приматах позволило значительно увеличить время жизнеспособности трансплантата по сравнению с кожей обычных свиней и с аллогенным трансплантатом [60, 61].
На данный момент из биологических покрытий при законодательном ограничении использования трупной кожи наиболее распространенными являются препараты свиной дермы (Аллоаск Д, Ксидерм, Ксенодерм, Свидерм и др.). В таблице
Коммерчески доступные продукты, полученные для хирургического применения представлены коммерчески доступные продукты, полученные для хирургического применения.
Синтетические раневые покрытия, накладываемые на раны после удаления струпа, сами являются важным элементом лечения. Они не только предотвращают истощение организма и инфицирование ран, но и готовят раны к последующей кожной пластике. Раневые покрытия, применяющиеся после удаления струпа, должны быть высокоадгезивными и быстро прикрепляться к поверхности раны, быть непроницаемыми для воды и иметь ограниченную проницаемость для паров и воды, уменьшать потери тепла через раневые поверхности, снижать потери белков и электролитов, предотвращать микробную инвазию ран, снижать чувство боли, облегчать проведение физиотерапевтических мероприятий, обеспечивать безболезненное проведение перевязок, не подвергаться протеолитическому расщеплению, способствовать очищению ран от тканевого детрита, сокращать время заживления глубоких дермальных и донорских ран, обладать гемостатическим действием, улучшать общее состояние пациента. Синтетические раневые покрытия перед тканями природного происхождения имеют ряд важных преимуществ: они не теряют своих свойств при хранении, не требуют смены на ранах, удобны в использовании. Среди большого перечня такого рода препаратов можно отметить Фолидерм, Биобран, Сиспусдерм, Омидерм, Эпигард, Синкрит, или Синкавер. Особым преимуществом этих покрытий является возможность постоянно располагать стерильным и относительно дешевым материалом в неограниченном количестве. Вместе с тем препараты импортного производства в силу своей высокой стоимости часто недоступны.
По анатомической структуре кожные эквиваленты (заменители) подразделяются на эпидермальные, дермальные и дермоэпидермальные [20, 56, 62].
Эпидермальные заменители кожи получили развитие после того, как стало возможным серийно культивировать in vitro
человеческие кератиноциты. Эти технологии довольно быстро нашли свое клиническое применение, что способствовало улучшению показателей выживаемости пациентов. Тем не менее значение культивированных кератиноцитов остается спорным и по настоящий день. Ключевым моментом в производстве эпидермального заменителя является выделение кератиноцитов от донора и их последующее культивирование
in vitro
для получения необходимого количества кератиноцитов для терапевтических нужд. Существуют различия в подходах к производству эпидермальных заменителей, которые зависят от методов культивирования, стадии дифференцировки клеток и эпителиальной организации (сливающиеся листы, субконфлюентные клеточные слои и суспензии); способов доставки клеток пациенту (в виде сливных листов, аэрозоля или с помощью микроносителей), а также от использования дополнительных подложек для повышения эффективности доставки культур клеток.
Для того чтобы получить культуру аутологичных клеток, производят биопсию кожи размером 2—5 см2 по прибытии пациента в клинику. Эпидермис отделяют от дермы и кератиноциты высвобождают путем воздействия ферментов. Полученные кератиноциты высевают в сосуд для культивирования, где одиночные клетки начинают делиться, образуя колонии, в присутствии митотически инактивированых фибробластов мыши и культуральной среды, содержащей фетальную телячью сыворотку и необходимые добавки. Единичные колонии кератиноцитов сливаются вместе и образуют эпителиальные слои, которые могут быть отторгнуты ферментативно от культуральной колбы и помещены на бэк-носители (такие как парафин, марля) для поддержания базально-апикальной ориентации клеток, а затем наносятся на рану. Качество такого стратифицированного культивируемого эпителиального аутотрансплантата (CEAS) зависит от клонального клеточного состава, который определяет выживаемость трансплантата и долгосрочность существования при применении в естественных условиях. Среди других недостатков CEAS можно отметить длительное время культивирования, хрупкость трансплантатов, сложность обработки и проведения процедур. Также существует потребность в точной координации во времени между получением культуры и ее доставкой в клинику. Основным недостатком применения листа являются непредсказуемые клинические исходы.
К числу коммерчески доступных эпидермальных заменителей кожи можно отнести такие, как Epicel (EPIBASE, EpiDex), MySkin, Laserskin (Vivoderm), Bioseed-S, CellSpray [56].
Дермальные заменители кожи.
Основными структурными компонентами дермы являются клеточные и волокнистые элементы, а также межуточное вещество. Волокнистые элементы в основном представлены коллагеновыми и эластиновыми волокнами, межуточное вещество — гликопротеинами, протеогликанами и гликозаминогликанами. Главный функциональный клеточный элемент дермы — фибробласт. Клеточная популяция фибробластов является источником образования практически всех структурных компонентов дермы, поэтому при создании заменителей кожи большинство ученых используют коллагеновый субстрат, смешанный с фибробластами и гликозаминогликанами, что служит основным компонентом дермального эквивалента [63—65]. Главное преимущество дермального эквивалента связано с тем, что клетки в нем находятся в активном функциональном состоянии, близком к таковому в коже [66—68]. Однако обычный дермальный эквивалент является нестойкой конструкцией, так как фибробласты, включенные в гель, вызывают его быструю контракцию. В связи с этим биологическая структура не может длительно храниться, что делает неудобным ее использование.
Большинство коммерчески доступных дермальных заменителей кожи являются бесклеточными и основаны они на аллогенных, ксеногенных или синтетических материалах. Получить лицензию на их производство намного легче в сравнении с конструкциями, содержащими клетки и двуслойные заменители кожи. Возможность производить крупные партии продуктов привела к довольно широкому их распространению и применению в клинике. К числу коммерчески доступных продуктов можно отнести AlloDerm, Karoderm, SureDerm, GraftJacket, содержащие ацеллюлярные продукты дермального человеческого матрикса, а также такие продукты, как OASIS Wound Matrix, EZ Derm, Integra Dermal Regeneration Template, Terudermis, Pelnac Standard Type/Pelnac, Fortified With Mesh Type, Biobrane, Biobrane-L, TransCyte, Dermagraft Hyalomatrix PA, Hyalograft 3D [56].
Дермальный эквивалент не является полноценной кожей, так как в его структуре отсутствует поверхностный слой кожи — эпидермис. Для создания полнослойной кожи и более быстрого восстановления жизнеспособности пересаженного эквивалента кожи на поверхность дермального матрикса накладывается пласт кератиноцитов. Такой тканевой продукт называется живым эквивалентом кожи [69, 70] и является дермоэпидермальным заменителем.
Дермоэпидермальные заменители имитируют гистологическую структуру нормальной кожи, где присутствуют как эпидермальные, так и дермальные слои. Существует также некоторое их функциональное сходство с нормальной кожей. Это не только самые передовые и сложные технологии и продукты по сравнению с эпидермальными и дермальными заменителями, но и самые дорогие биологические конструкции в тканевой инженерии кожи.
Один из первых вариантов живого эквивалента кожи был предложен E. Bell в 1983 г. [37]. Дермальная составляющая была представлена гелем, состоящим из фибробластов кожи, коллагена, плазмы и ростовой среды. На поверхности этого геля в сроки от 1 до 2 нед выращивались кератиноциты. Трансплантация аллогенных кератиноцитов создавала условия для краевой эпителизации за счет синтеза компонентов базальной мембраны, связанных с ними цитокинов и факторов роста [71]. В результате создавалась 3D-модель кожи, представляющая жизнеспособную ткань в виде полупрозрачной упругой массы.
Клеточные конструкции в виде живых эквивалентов кожи используются как при глубоких ожогах, так и при других глубоких трехмерных дефектах кожного покрова. Кроме того, они являются прекрасной моделью для изучения процессов регенерации и морфогенеза in vitro
[2, 72].
Несомненным преимуществом живого эквивалента кожи является то, что в результате его приживления формируется полноценная в морфофункциональном отношении кожа.
Большинство существующих коммерчески доступных дермоэпидермальных заменителей кожи основаны на использовании аллогенной кожи, что позволяет получать большие количества однородной партии продукта с относительной доступностью. Тем не менее эти биоматериалы действуют скорее как временные биологически активные перевязочные материалы, обеспечивающие кожу больного человека факторами роста, цитокинами в процессе заживления ран. Наиболее известными из них являются Alligraft, Karoskin, Apligraft, Or-Cel, PolyActive [56].
Двух- и трехмерные модели искусственной кожи
Известные к настоящему времени эквиваленты кожи чаще всего культивируют на 2D-субстратах, таких как культуральные пластины, или в условиях 3D-матрикса. При этом показано, что клетки, культивируемые на 2D-субстратах, растут в условиях, не соответствующих естественным условиям среды, теряют множество важных внутриклеточных сигналов, ключевых регуляторов и тканевых фенотипов, не в состоянии воспроизвести сложные динамические процессы, протекающие в коже в естественных условиях [73].
Клетки, растущие в 3D-условиях, имеют экспрессию рецепторов на клеточной поверхности, выраженную пролиферативную способность и метаболические функции [73—75]. Показано, что только в 3D-условиях кератиноциты формируют упорядоченный эпителий [74—78]. Таким образом, стратегии, которые позволяют конструировать искусственные эквиваленты кожи человека в 3D-условиях, в том числе дермального и эпидермального компонентов, позволяют изучать физиологию клеток, что не может быть осуществлено в монослое культуры ткани.
Прикладные аспекты применения искусственной кожи
Технологии создания микротканей могут быть использованы для лечения дефектов покровного эпителия, восстановления после операций, травм, ожогов, свищей, в реконструктивной хирургии. В настоящее время известно применение методов трансплантации аллогенных культивированных клеток (фибробласты и кератиноциты) в комбустиологии при лечении длительно незаживающих гранулирующих кожных ран, трофических язв и свищей, для восполнения фибробластами голосовых связок, мягких тканей лица [79—82].
Эквиваленты кожи в настоящее время изучаются и используются в клинике при ряде патологий кожи. По данным литературы [83—100], заболевания, при которых могут быть применены эквиваленты кожи человека, включают псориаз, витилиго, келоидные рубцы, невусы, генодерматозы, такие как пигментная ксеродерма и врожденный буллезный эпидермолиз.
3D-модели кожи могут быть с успехом использованы при проведении научных исследований [101]. Эти модели позволяют изучать базовую архитектуру кожи человека, межклеточные взаимодействия, влияние окружающей среды на регуляцию меланогенеза, пролиферацию и дифференцировку кератиноцитов, а также закономерности процессов эпителизации в ранах. Эти модели кожи также представляют платформу для моделирования фотостарения и рака кожи, являются отличной системой при проведении фармакологических исследований для тестирования лекарственных препаратов, оценки их фармакологической активности и токсичности. Такие исследования проводятся на образцах микротканей, моделирующих нормальную ткань, заболевания, опухоли различного генеза. Кроме того, 3D-эквиваленты кожи человека могут быть сконструированы с определенными генетическими изменениями в дермальном или эпидермальном компартментах модели и служить основой для изучения влияния окружающей среды на эти модификации. 3D-модели кожи также являются экономически эффективной альтернативой использованию лабораторных животных, в частности в токсикологических исследованиях, в оценке безопасности косметических средств, фототоксичности и генотоксичности различных реагентов [102—104].
Заменители (эквиваленты) кожи человека в настоящее время коммерчески доступны, однако существует ряд проблем, касающихся доклинической оценки безопасности. В частности, при предоставлении эквивалента кожи для клинического использования компании должны продемонстрировать отсутствие в нем патогенов, иммуногенных свойств, туморогенности, наличие нормальных физиологических функций.
Авторы заявляют об отсутствии конфликта интересов.
1e-mail 2e-mail
Техника операции
OLYMPUS DIGITAL CAMERA
Пересадка кожи при ожогах проводится в несколько этапов.
- Специальным инструментом проводится забор материала для трансплантации. Этот этап опускается, если трансплантационным материалом служит не собственная кожа.
- Ожоговая рана подготавливается к пересадке: производится зачистка раневой поверхности, удаляются некротические ткани, иссекаются грубые рубцы по краям раны, раневое ложе выравнивается, обрабатывается антисептиком, орошается раствором антибиотика.
- Трансплантат совмещается с краями раневой поверхности, при необходимости фиксируется кетгутом (самостоятельно рассасывающийся шовный материал), смесью растворов фибрина и пенициллина.
- Донорский материал орошается растворами глюкокортикостероидов для снижения риска отторжения.
- На пересаженный материал накладываются влажные ватные шарики и тампоны, сверху – давящая повязка.
Используемые материалы
Существуют различные синтетические и природные материалы, используемые для дермопластики:
- аутокожа – собственная кожа, взятая с необожженного участка тела, который обычно скрыт одеждой (внутренняя поверхность бедра, спина, ягодицы);
- аллокожа – трупная кожа (отобрана у мертвого человека), законсервированная для последующего применения в трансплантационной хирургии;
- ксенокожа – кожа животных (чаще – свиная);
- амнион – зародышевая оболочка эмбриона человека и высших позвоночных (пресмыкающиеся, птицы, млекопитающие);
- выращенные в искусственных условиях коллагеновые и эпидермальные материалы.
Кожную пластику чаще всего специалисты проводят с применением биологических материалов – аутокожи и аллокожи. Амнионом, ксенокожей, другими синтетическими и природными материалами раневую поверхность в основном покрывают временно, с целью предотвращения инфицирования.
При выборе подходящего материала также учитывается глубина ожога. При травмах 3Б и 4 степени рекомендуется использовать собственную кожу, тогда как при повреждениях 3А степени пластику проводят с применением аллокожи.
При пересадке собственной кожи могут применяться лоскуты, взятые с определенного участка тела, никак не соединяющиеся с другими тканями и органами. Такой вид операции называется свободной пластикой. Операция с использованием расположенной вокруг раны кожи, которая с помощью микроскопических разрезов смещается и натягивается на ожоговую область, называется несвободной пластикой.
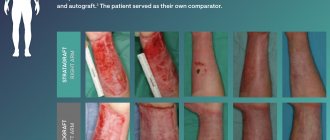
Качество и физические характеристики трансплантата зависят от толщины лоскута. По этому параметру донорские материалы классифицируются на 4 вида.
- Тонкий лоскут (не более 20-30 микрон). Включает эпидермис и базальный слой дермы. Характеризуется плохой эластичностью, часто сморщивается, легко повреждается, поэтому при ожогах используется очень редко, в основном для временного покрытия ожоговой области.
- Лоскут средней толщины, иначе промежуточный, расщепленный (от 30 до 75 микрон). Состоит из эпидермиса и дермы (полного или частичного слоя). Характеризуется высокой прочностью и эластичностью, практически не отличается от собственной здоровой кожи. Для трансплантации после ожогов используется чаще всего, подходит для восстановления кожи на подвижных участках (суставные поверхности), поскольку обладает достаточной эластичностью, не затрудняет движения.
- Толстый лоскут (50-120 микрон). Включает все слои кожного покрова. Используется при очень глубоких ранах или повреждении открытых участков тела (лицо, шея, область декольте). Пересаживается только на участки, где есть достаточное количество капилляров, которые будут соединяться с сосудами донорского лоскута.
- Композитный лоскут. Кроме собственно кожи, включает подкожную жировую клетчатку и хрящевую ткань. Используется при ожогах лица.
Об участке-реципиенте
После операции участок-реципиент может быть закрыт давящей или вакуумной повязкой.
Давящая повязка
Давящая повязка поможет участку-реципиенту зажить правильно. Она оказывает давящее действие на участок-реципиент, за счет чего под ней не накапливается жидкость. Это позволяет кожному лоскуту приклеиться к коже. Она может крепиться с помощью шелковых швов, шины, гипсовой или поддерживающей повязки. Благодаря этому лоскут не будет смещаться.
Ваш хирург или медсестра/медбрат снимет давящую повязку примерно через 5–7 дней после операции. После снятия давящей повязки участок-реципиент закроют повязкой Xeroform.
Если у вас наложена гипсовая повязка, хирург вырежет ее часть над участком-реципиентом. Это позволит ему осмотреть лоскут. Гипсовую повязку снимут через 10 дней после операции, если вам не проводили другие операции. Если вам проводили и другие операции, возможно, вам придется носить гипсовую повязку дольше. Для закрепления повязки Xeroform после снятия гипсовой повязки будет использоваться бандаж Ace®, марлевый бинт или пластырь.
Возможно, вам скажут, что нужно менять повязку Xeroform и марлевый бинт один раз в день до полного заживления лоскута. Медсестра/медбрат научит вас и лицо, ухаживающее за вами, как менять повязку.
Вакуумная повязка для ран
Вместо давящей повязки хирург может использовать для участка-реципиента вакуумную повязку. Вакуумная повязка — это специальная повязка, с помощью которой из раны отсасывается жидкость, что ускоряет заживление.
Вакуумную повязку для ран снимут через 5–7 дней после операции. После этого хирург осмотрит лоскут, чтобы убедиться в его полном заживлении. Если лоскут полностью не зажил, возможно, вам потребуется носить вакуумную повязку дольше.
Вернуться к началу
Осложнения
Одним из основных осложнений кожной пластики является отторжение трансплантата, которое может возникнуть даже после пересадки собственной кожи. Причиной подобного явления чаще всего становится наличие в ране остатков гноя, некротических клеток, лекарственных веществ.
При отторжении возникает полный или частичный некроз пересаженной кожи. В этом случае омертвевшие ткани удаляют, после чего проводят повторную пересадку. Если отторжение частичное, удаляют только очаги некроза, оставляя прижившиеся ткани.
К другим распространенным осложнениям кожной пластики относят:
- кровоточивость послеоперационных швов;
- уплотнение тканей и формирование рубцов по краю раневой поверхности (в месте соединения здоровой и донорской кожи);
- вторичное инфицирование раны (при нарушении правил предоперационной подготовки либо несоблюдении асептики во время хирургического вмешательства);
- сепсис;
- растрескивание донорской кожи, появление на ее поверхности язв и эрозий, ограничение движений из-за стягивания, особенно на суставных поверхностях (происходит при неправильном выборе материала или несвоевременном проведении трансплантации);
- снижение чувствительности, атрофия (уменьшение объема) тканей в зоне пересадки.
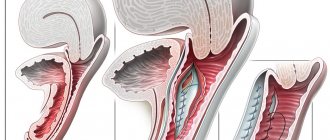
Микрохирургические методики пересадки кожи при трофической язве
Применяется при закрытии раны над открытым сухожилием или суставом, при возобновлении над опорными зонами целостности кожи. Цель методики в формировании лоскута из кожи на сосудистом основании, который можно поворачивать в разном направлении, не нарушая трофику. Описываемый способ требует руки профессионала, однако в случае выполнения получается отличный результат. Есть концепция с предварительным выделением кожно- мышечного лоскута с сосудистым основанием и пересадкой его на проблемную зону, где также следует «включить» в работу сосуды, что будут ее питать.
Плюсы и минусы пластики кожи
Трансплантация кожи после ожога, как и все другие виды пластики, имеет свои преимущества и недостатки. К первым можно отнести:
- защиту раны от инфицирования и механических повреждений;
- предотвращение испарения влаги и потери питательных соединений через открытую поверхность раны;
- более эстетичный внешний вид после заживления раневой поверхности.
Из недостатков хирургического вмешательства можно выделить:
- возможность отторжения пересаженного материала (при пересадке собственной кожи риски значительно ниже);
- вероятность развития других осложнений;
- психологический дискомфорт пациента (к примеру, если донорским материалом выступает трупная кожа или ткани, взятые с ампутированной конечности).
Стоимость
Стоимость кожной пластики определяется различными факторами: площадью поврежденной поверхности и сложностью конкретной операции, видом используемых для трансплантации материалов и анестезии, прочих фармакологических средств, квалификацией и профессионализмом хирурга, расположением и репутацией клиники. В зависимости от этих факторов цена на операцию может составлять от 10 000 до 200 000 рублей.
Пластика кожи после ожога не является сложной и продолжительной операцией. Но в некоторых ситуациях приживление трансплантата после пересадки протекает плохо, даже если донорским материалом является собственная кожа. Детальная подготовка к пластической операции, правильный расчет сроков ее проведения, соответствующий уход в период реабилитации являются обязательными условиями успешной пластики кожи и позволяют свести к минимуму вероятность развития послеоперационных осложнений.
Классификация трансплантатов для пересадки
Для трансплантации кожи предпочтительно забирать материал у самого пациента (аутотрансплантат). Если это невозможно, используют живого или умершего донора (аллотрансплантат). Иногда врачи используют кожу животных, особенно свиней. В развитых клиниках практикуется выращивание синтетической кожи — эксплантата.
В зависимости от глубины поражения материал для трансплантации делится на три типа:
- тонкие — до 3 мм. Биоматериал состоит из верхнего и дополнительного слоев кожи и имеет небольшое количество эластичных волокон;
- средний — 3-7 мм. Он состоит из сетчатого слоя, богатого эластичными волокнами;
- толщина — до 1,1 см. Он покрывает все слои дермы.
Выбор материала зависит от места ожога, его размера и индивидуальных особенностей тела.