Послеоперационные осложнения развиваются как минимум в 10% случаев всех операций. Для этого есть несколько причин.
Во-первых, ситуация, которая сделала необходимым оперативное вмешательство, не исчезает в момент операции. Больному предстоит долгое восстановление нормального функционирования организма.
Во-вторых, само по себе хирургическое вмешательство является нефизиологическим воздействием, нарушающим многие циклические процессы в организме. Здесь и введение наркотического вещества, нагружающего печень и почки, и изменение сердечного и дыхательного ритма, кровопотеря, болевые ощущения. Экстренные и длительные операции являются закономерными факторами возникновения осложнений. В норме на 3-4-е сутки организм справляется с неожиданными обстоятельствами, и самочувствие больного улучшается.
Лечение послеоперационных осложнений требует квалифицированного подхода со стороны врачей и медицинского персонала.
Глава 6. Основные причины развития АНГБК и симптомы заболеваний, связанных с ним
Волков Е.Е., Кэцинь Хуан Асептический некроз головки бедренной кости. Безоперационное лечение / Пер. с китайского В.Ф. Щичко. — М., 2010. — 128 с.: ил. ISBN 978-5-9994-0090-1
УДК 616.7 © Волков Е.Е., Кэцинь Хуан, 2010 © ХуанДи 黄帝
Наиболее частыми причинами АНГБК являются алкогольная интоксикация, курение и чрезмерное употребление глюкокортикоидов.
6.1. Некроз головки бедренной кости, обусловленныйалкогольной интоксикацией
6.2. Некроз головки бедренной кости, связанный скурением
6.3. Некроз головки бедренной кости, вызванный глюкокортикоидами
6.4. Остеопороз
6.5. Врождённое варусное положение шейки бедренной кости
6.6. Красная волчанка
6.7. Метаболические заболевания кости
6.8. Нейротрофические заболевания костей и суставов
6.9. Гиперпаратиреоз
Стадии
Этапы развития некроза костей и суставов следующие:
- Первая стадия. Характеризуется разрежением костной ткани, чаще протекает бессимптомно или со слабой симптоматикой, не определяется на рентгеновских снимках.
- Вторая стадия. Сопровождается локальными некротическими изменениями и мелкими компрессионными переломами, деформацией суставной поверхности кости и расширением суставной щели, что видно на рентгеновских снимках. Клинически вторая стадия проявляется болевым синдромом и ограничениями функций сустава.
- Третья. Участки некроза отделяются. На рентгеновских снимках хорошо просматриваются контуры и патологическая структура секвестров. Суставная поверхность продолжает деформироваться. На данном этапе сустав практически полностью теряет свои функции, пациент страдает от выраженного болевого синдрома
- Четвертая. При отсутствии гнойного процесса начинается постепенное восстановление костной ткани.
- Пятая. Структура кости восстанавливается, но форма остается измененной. Костная ткань разрастается с образованием остеофитов. В дальнейшем формируется анкилоз (сращение сустава).
6.1. Некроз головки бедренной кости, обусловленный алкогольной интоксикацией
У определённой части больных асептическим некрозом головки бедренной кости (АНГБК) это заболевание возникло по причине длительной хронической интоксикацией алкоголем.
Воздействие алкоголя на процесс развития АНГБК детально описано на примере следующего эксперимента. Сравнивали группы животных с моделируемым некрозом головки бедренной кости: группу, где давали крепкие спиртные напитки (свыше 50°), и контрольную группу.
Для наблюдения за изменениями использовали методы радиологии, обработку изображений с помощью вычислительной техники и под электронным микроскопом, а также данные серологии и гистологии. Результаты экспериментов подтвердили, что в группе животных с моделируемым АНГБК, которым давали крепкие спиртные напитки, были выявлены нарушения жирового обмена, серьёзные повреждения клеточных оболочек, фиброзный атеросклероз в артериолах и большое количество жировых капель в клеточных лакунах, скручивание капилляров, их истончение, закупорка и ишемия. Вследствие токсического действия перекисных липидов и спирта, а также продуктов обмена веществ, произошло повреждение костных клеток и их жировое перерождение, а также возникли некроз и разрыв трабекул, количество лакун в полостях костей возросло. Чрезмерное употребление алкоголя приводит к увеличению количества жировых капель в пери ферическом кровообращении и превращению их в жировые шарики, в результате чего происходят эмболия и некроз в субхондральных капиллярах головки бедренной кости.
В ходе эксперимента установлено, что в костно-мозговых полостях увеличилось количество жирных веществ, а в субхондральных клетках головки бедренной кости возникло осаждение жироподобных веществ, костная структура разрушилась, трабекулы стали рыхлыми и беспорядочными, скелет был утрачен. Результаты экспериментов свидетельствуют о том, что хроническая интоксикация алкоголем может привести к АНГБК, а также к ряду патологических изменений в гистологии, биомеханики, физики и биохимии кости, в результате чего разрушается структура головки бедренной кости и костные клетки гибнут, возникают инфаркт капилляров и странгуляционная непроходимость.
Кроме того, установлено, что у 53,2 % людей, длительное время употребляющих алкоголь, в печени накапливается избыточное количество жира (так как спирт нарушает жировой обмен), вызывая жировую эмболию и закупорку кровеносных сосудов, что приводит к облитерации системы микроциркуляции крови в кости. Действие спирта способствует остеопорозу, притупляет передачу ощущений от нервно-волокнистых пучков тазобедренного сустава, ослабляет болевой порог, снижает степень физиологической реакции, что приводит к статическим и динамическим перегрузкам и возникновению некроза головки бедренной кости.
Тот факт, что хроническая интоксикация алкоголем может вызвать некроз головки бедренной кости, уже привлёк внимание практикующих врачей. Большое количество клинических случаев также подтверждает этот вывод, и если больной АНГБК во время лечения продолжает пить спиртное, то это отрицательно сказывается на результатах лечения.
Зарубежные учёные Cold и Cageni, обследовав 790 больных, злоупотреблявших алкоголем, установили, что на рентгенограммах 1580 головок бедренной кости в 260 были видны разрушение их структуры, коллапс и некроз. Японские учёные, обследовав 1098 любителей спиртного, обнаружили, что у 60% пациентов, ежедневно выпивавших более 0,54 л спиртного, был зафиксирован асептический некроз головки бедренной кости. Выборка из клинической статистики авторов показала, что из 1507 больных АНГБК 927 имели пристрастие к спиртному. Результаты проведённых функциональных исследований подтвердили тот факт, что хроническая алкогольная интоксикация способствует возникновению АНГБК, что дало возможность найти новые пути к профилактике и лечению.
6.2. Некроз головки бедренной кости, связанный с курением
Согласно статистике, сегодня в мире от заболеваний, вызванных курением, ежегодно умирает примерно 4 млн человек. Среди больных АНГБК курящие составляют более 30 %, и у многих из них состояние здоровья неудовлетворительное. К 2022 г. число людей, погибших вследствие курения, превысит количество людей, умерших от любого другого заболевания, включая СПИД. Курение станет самым главным эпидемическим заболеванием в XXI в.
Табак при горении выделяет более 4000 токсичных веществ, из которых, как сейчас известно, более 40 — канцерогенные. Курение является главной причиной возникновения сердечно-сосудистых и цереброваскулярных болезней. Заболеваемость раком лёгких у курящих в 20 раз выше,чем у некурящих. Один из научно-исследовательских центров в США, работая над данной проблемой в течение 35 лет, подтвердил, что существует явная связь между курением и раковым заболеванием: у тех, кто выкуривает больше 1 сигареты в день, риск заболевания раком сразу же возрастает в 2 раза, а у тех, кто выкуривает более одной пачки сигарет, возможность заболеть раком возрастает в 20 раз. Курящие легко заболевают язвой желудка и двенадцатиперстной кишки, а также неврастенией.
Активные и пассивные курящие — больные некрозом головки бедренной кости — отравляют себя никотином и свинцом, которые скапливаются в организме и нарушают кровообращение, разрушают костную структуру и усугубляют некроз головки бедренной кости. После курения никотин быстро поступает в кровоток и раздражает симпатический нерв и хромаффинные клетки, стимулирует выработку надпочечниками активных факторов, вызывающих увеличение в плазме крови ангиотензина и вазоактивных элементов. В разных тканях количественное распределение α- и β-рецепторов различно, что способствует сокращению периферических кровеносных сосудов в тканях и расширению центральных сосудов, спазму артериол, увеличению сосудистого сопротивления, нарушению венозного оттока, возрастанию вязкости крови, препятствуя микроциркуляции в головке бедренной кости, в результате костные ткани перестают получать питание и ускоряется разрушение костной структуры головки бедренной кости.
Таким образом, курящие пациенты усугубляют течение АНГБК, замедляя восстановление здоровья. Вред, наносимый курящими обществу Ещё более опасно то, что выдыхаемый курящими дымнаносит даже больший вред окружающим, чем самим курящим. Исследования, проведённые учёными, подтвердили, что в Шанхае у 37,8 % детей школьного возраста уровень свинца в крови превышает допустимые показатели. При каждом повышении уровня свинца в крови детей на 100 мг показатель умственного развития снижается на 6—8 баллов, а основной причиной отравления детей свинцом является пассивное курение, создаваемое дома родителями. В связи с этим, для сохранения здоровья детей и других людей необходимо создать в обществе среду, свободную от курения.
Активно и пассивно курящие женщины, помимо того что они вредят себе, они ещё и губят своё потомство, так как курение плохо влияет на психосоматическое развитие плода, наносит серьёзный ущерб интеллектуальным способностям детей. Если у кормящей матери в молоке есть никотин, то это оказывает отрицательное влияние на здоровье ребёнка. Авторы надеются, что каждый больной АНГБК проявит высокую общественную сознательность: будет держаться подальше от сигарет и дорожить здоровьем своих близких и других людей.
6.3. Некроз головки бедренной кости, вызванный глюкокортикоидами
Обычно некроз головки бедренной кости, вызванный глюкокортикоидами, проявляется либо через 2—3 недели, либо через 1—2 года после приёма этих препаратов. В 1949 г. Hench описал лечение ревматоидного артрита с помощью глюкокортикоидов (далее кратко именуемые гормонами), широко применяемых при лечении различных трудноизлечимых болезней и позволяющих получить удовлетворительные результаты. К сожалению, будущее показало, что они оказывают и неблагоприятное воздействие. Fisher и соавторы (1969), проводя патологоанатомические исследования при АНГБК, вызванного гормонами, обнаружили, что костномозговые полости и костные клетки наполнены жировыми включениями, жировое перерождение печени, гиперлипидемию. Жировые капли в крови также могут приводить к субхондральной эмболии, интрамедуллярному застою крови, повышению внутрикостного давления и отёку костного мозга из-за гипоксии. Harrington (1971) сообщил о двух группах больных, которым была выполнена трансплантация почки. В 1-й группе больных через 3 недели после операции при среднем уровне преднизолона в 2 900 мг у 24% больных был обнаружен некроз головки бедренной кости. Во 2-й группе, в которой уровень преднизолона составил 1180 мг, только у 2 больных из 116 (2%) возник некроз головки бедренной кости. То есть в 1-й группе заболеваемость некрозом была в 10 раз выше, чем во 2-й группе.
Результаты других экспериментов подтвердили, что если здоровым белым кроликам каждую неделю делать инъекцию ацетата гидрокортизона из расчёта 8 мг/кг, то через 3 месяца под микроскопом после вскрытия можно обнаружить хрупкую и рассыпчатую костную ткань в головке бедренной кости, увеличение жира в субхондральных полостях головки бедренной кости, уменьшение содержания костных клеток в трабекулах, густую окраску некоторых пикнотических ядер клеток, исчезновение части костных клеток в костных лакунах, заметное снижение числа костных клеток на единицу площади. В кровеносных сосудах скелета можно увидеть, что жировые эмболы распределены в субхондральной части головки бедренной кости, клетки отёчны, в мозговой ткани шейки бедренной кости необычно много жировых клеток. Кроме того, видны компрессионные венулы, образованные кровяным синусоидом, запирательные отверстия неясные, количество капилляров уменьшилось и их наполнение недостаточное, а в капиллярах, расположенных ближе к краям хрящей, кровенаполнение очень плохое, плотность капилляров на единицу площади в головке бедренной кости значительно уменьшилась, сеть капилляров заметно поредела, кровоток в артериолах и капиллярах приобрёл песчаный вид, появилась агрегация эритроцитов, скорость кровотока снизилась.
Результаты серологического исследования подтвердили, что в сыворотке крови животных повысилось содержание общего холестерина и триглицеридов. Результаты эксперимента свидетельствуют о том, что глюкокортикоиды сильно разрушают трабекулы, капилляры и субхондральную структуру головки бедренной кости, которая утрачивает механические свойства, и всё это приводит к отмиранию её клеток.
Именно таким образом гормоны вызывают АНГБК. Механизм этого некроза состоит в нарушении жирового обмена, что способствует появлению гиперлипидемии и жирового перерождения печени, а также большому скоплению жировых клеток в костномозговой полости головки: происходит жировая эмболия в системе её кровообращения, гипоксия костных клеток, отёк и разрушение костного матрикса. В результате кости становятся хрупкими и может легко произойти их перелом. Увеличение количества жировых клеток в костномозговой полости головки бедренной кости и уменьшение числа костных клеток в трабекулах, а также компрессия, которой подвергаются капилляры в результате разрушения структуры, ускоряют возникновение некроза.
АНГБК, вызываемый гормонами, относят к категории медикаментозного некроза кости. В настоящее время заболеваемость данного типа имеет тенденцию к возрастанию, поэтому медикам необходимо тщательно проанализировать, есть ли ещё лекарственные препараты, способные, подобно глюкокортикоидам, вызывать некроз головки бедренной кости.
Виды послеоперационных рубцов
Келоидный.
Бугристый рубец из разросшейся соединительной ткани красного или синюшного цвета. На вид напоминает опухоль или шляпку гриба. Размер келоидного рубца больше самой раны, он болит, чешется, иногда пульсирует.
Гипертрофический.
Внешне похож на келоидный, но его размеры не выходят за пределы раны. Гипертрофический рубец не доставляет неприятных ощущений, со временем светлеет.
Нормотрофический.
Хорошо заживающий рубец – вначале выпуклый и покрасневший, спустя 3 месяца становится почти незаметным, чувствительность отсутствует.
6.4. Остеопороз
Остеопороз (лат. osteoporosis) — заболевание костной ткани вследствие нарушения обменных процессов, проявляющихся изменением структуры и истончением кости, ведущим к деформации и переломам. Основные изменения, характерные для остеопороза и определяемые при специальных исследованиях, выражаются в снижении количества несущих трабекул и массы кости на единицу площади.
Формирование скелета, как правило, к 24—25 годам обеспечивает пик костной массы, затем, с увеличением возраста, кости истончаются, становятся менее прочными и упругими. Частично это можно объяснить тем, что примерно после 35 лет вымывание кальция из костей происходит более интенсивно, нежели транспорт и отложение в костную ткань. Это, как правило, присуще всем, но у некоторых людей при определённых изменениях обменных процессов теряются белки костной ткани, нарушается баланс микроэлементов и вымывание становится избыточным, что, в конечном итоге, приводит к остеопорозу.
Остеопороз поражает весь скелет, но особенно часто: бедра, предплечья и позвонки. Если посмотреть среднестатистическую графическую картину изменений плотности кости в соответствии с возрастом, то мы увидим период низкой плотности кости у растущего и развивающегося организма, когда обменные процессы представлены преимущественно образованием кости и её незначительной резорбцией. Это характерно для детского и юношеского возраста. В 25 лет, когда достигнута максимальная минеральная плотность кости и обменные процессы костеобразования и резорбция (рассасывание) уравновешены, плотность кости удерживается. После 50 лет, когда в силу определённых сдвигов в обменных процессах и эндокринных изменений резорбция превалирует над костеобразованием, в организме формируется механизм потери плотности кости в среднем на 3—5% в год.
Биохимические показатели у больных остеопорозом свидетельствуют не только о снижении содержания кальция, преимущественно ионизированной формы, и фосфора в крови, но и об увеличении содержания щёлочных фосфатов и уменьшении уровня кальция в моче. Общее количество кальция в организме составляет 1,2—1,5 кг, наличие других неорганических веществ — фосфора, натрия, калия, магния — необходимо для поддержания обменных процессов, всасывания кальция кишечником и транспорта белками, а также для реабсорбции кальция канальцами нефрона. В костных тканях имеется преимущественно 25—30% воды и 70—75% неорганических и органических веществ.
Неорганические вещества содержат 60—70% фосфата кальция и карбоната кальция (примерно 700 г), из них 99% находится в костных тканях. Фосфора в костях примерно 440 г. Из органических веществ содержание оссеина составляет 20—40%. Органические компоненты кости образуют сетчатую структуру, которая придаёт прочность кости и выдерживает различные напряжения. Результаты исследований подтверждают, что неорганические вещества позволяют кости выдерживать сжатие, а органические коллагеновые волокна — растяжение.
Кость, являясь идеальным структурным материалом, играет роль опоры и рычага, обладает высокой прочностью и небольшой массой. Некоторые исследователи считают, что кость намного прочнее гранита, а её плотность намного меньше, чем у стали и гранита. Кость обладает наибольшим сопротивлением на сжатие в продольном направлении, а при растяжении — легко повреждается, поэтому размещение трабекул зависит от несущей способности кости.
Распределение напряжения в кости под воздействием нагрузки зависит от формы и структуры самой кости. Способность кости выдерживать продолжительное напряжение и усталость ограничена. Кость очень чувствительна к физиологическому раздражению напряжением: чем больше сила напряжения, тем больше становится трабекул и плотность кости.
Рентгенограммы при остеопорозе свидетельствуют о том, что в губчатой кости трабекулы утолщаются и их количество уменьшается, а кортикальная кость истончается и приобретает слоистый вид. Нередко возникает расширение эпифизарной линии, а в детском возрасте на метафизе формируются образования в виде щётки.
Остеопороз могут сопровождать метаболические заболевания скелета: костный флуороз размягчённого типа, почечная остеодистрофия, гиперпаратиреоз, нарушения ассимиляции кальция, алиментарные остеодистрофии. Многофакторные изменения в организме в определённых условиях способствуют формированию остеопороза с облигатным изменением структуры головки бедренной кости и развитием АНГБК.
Остеопороз, вызывающий изменения структуры головки бедренной кости и приводящий к компрессионной обструкции микроциркуляторного русла, создаёт ишемию и условия для развития асептического некроза. Учитывая патогенетическую связь остеопороза и асептического некроза, для каждого врача и пациента очень важно использовать принцип индивидуальной диагностики и профилактики остеопороза с проведением обследований людей всё более молодого возраста, вплоть до детей и подростков, на предмет оценки у них скорости набора костной массы.
Перелом полового члена — травматический разрыв белочной оболочки кавернозных тел эрегированного полового члена.
В структуре неотложных андрологических состояний перелом полового члена занимает первое место. По данным ургентной андрологической службы по г. Москве на долю перелома полового члена приходится не менее 60% от общего числа пациентов, обратившихся за экстренной андрологической помощью [1].
При переломе полового члена в первую очередь рвется белочная оболочка тела полового члена, иногда в сочетании с надрывом спонгиозного тела и уретры. Травмой уретры сопровождается в среднем 10% переломов полового члена.
Перелом полового члена возможен только в состоянии эрекции. Разрыв белочной оболочки неэрегированного полового члена возможен, но встречается крайне редко. В связи со значительной в состоянии детумесценции толщиной белочной оболочки, составляющей в около 2 мм, тупая травма полового члена обычно не приводит к разрыву последней. Вследствие разрыва подкожных вен образуется гематома, которая имеет тенденцию к быстрому распространению. Ввиду хорошего кровоснабжения полового члена гематома может достигать значительных размеров, приводить к отеку крайней плоти, затруднять мочеиспускание, вплоть до необходимости дренирования мочевого пузыря.
Различия между истинным переломом полового члена и травмой неэрегированного полового члена имеют важное значение для клинической практики. При переломе полового члена всегда повреждается белочная оболочка, а иногда и кавернозные тела полового члена. При ушибе полового члена преимущественно повреждаются сосуды, иногда белочная оболочка, но кавернозные тела всегда интактны (разумеется, если нет полного размозжения органа) [2].
Диагноз перелома полового члена в подавляющем большинстве случаев чисто клинический, то есть основывается на результатах расспроса и физикального обследования пациента. Инструментальные методы обследования применяются для дифференциальной диагностики при неоднозначной клинической картине, а также для уточнения локализации и размеров дефекта белочной оболочки.
В момент возникновения травмы пациент отмечает звук хруста. Ранее это считалось патогномоничным для перелома полового члена, однако недавние исследования показали, что подобные явления встречаются и при изолированном подкожном разрыве сосудов полового члена, и при «ложном» переломе полового члена, заключающемся в разрыве внутреннего листка белочной оболочки. Практически немедленно происходит детумесценция, развивается острый отек органа и изменение окраски его кожных покровов. Болевой синдром закономерен при любой острой травме, однако взаимосвязь между выраженностью болевого синдрома и размерами дефекта белочной оболочки отсутствует. При осмотре половой член деформирован с отклонением в сторону противоположную локализации дефекта белочной оболочки.
Быстрое, иногда моментальное, наступление детумесценции имеет высокую диагностическую ценность как маркер разрыва белочной оболочки. Плавное, постепенное развитие детумесценции характерно для других видов травмы полового члена — «ложного» перелома, разрыва связки, поддерживающей половой член, разрыва подкожной вены полового члена.
Фасция Бака обычно при переломах полового члена сохраняет свою целостность, над местом дефекта белочной оболочки формируется плотная, напряженная, хорошо отграниченная от окружающих тканей гематома, носящая название симптом «указующего холма». В случае разрыва фасции Бака, что случается достаточно редко, гематома постепенно распространяется в мошонку, промежность и нижние отделы брюшной стенки.
В настоящее время при истинных переломах полового члена рекомендуется максимально активная хирургическая тактика, заключающаяся в ревизии полового члена, ушивании травматических дефектов, эвакуации гематом [3,4,5]. При повреждениях кавернозных тел естественное течение внутритканевой гематомы завершается сегментарным кавернозным фиброзом, следствием чего является развитие стойкой, необратимой эректильной дисфункции, не подлежащей консервативному лечению.
Описаны различные варианты оперативного доступа к кавернозным телам полового члена. На наш взгляд, предпочтение целесообразно отдать циркулярному субкорональному разрезу с последующей дегловацией кожи полового члена. В отличие от других (косметических) вариантов доступа, вышеописанный подход позволяет полностью билатерально обнажить кавернозные тела. При выявлении разрыва белочной оболочки сепарацию тканей ниже места разрыва выполнять не имеет смысла, т.к. дефект белочной оболочки практически всегда единичный.
По данным ургентной андрологической службы по г. Москве, частота осложнений при таком доступе менее 5%. В структуре осложнений доминирует некроз кожи полового члена, также возможно нагноение послеоперационной раны, формирование абсцесса. Острый кавернит для данной клинической ситуации нехарактерен — нами не наблюдалось ни одного случая кавернита, осложнившего перелом полового члена.
Для ушивания разрыва белочной оболочки должен использоваться рассасывающийся шовный материал. При использовании нерассасывающегося шовного материала остающиеся узлы могут быть источником болезненных ощущений для пациента, и затруднять проведение полового акта.
Обязательным этапом оперативного вмешательства является выполнение пробы Гиттеса: наложение турникета по основание полового члена с последующим пунктированием иглой «бабочкой» интактного кавернозного тела и последующей инстилляцией изотонического раствора хлорида натрия. Данный тест позволяет не только выявить недиагностированные ранее дефекты оболочки, но и проверить герметичность наложенных лигатур [6].
Перелом полового члена — ситуация, требующая экстренной помощи, поэтому такие пациенты могут попадать во все урологические отделения. В виду сравнительно малой частоты встречаемости перелома полового члена, существенная часть специалистов-урологов испытывает затруднения при оказании помощи этой специфической категории больных. Редко, но все еще имеют место случаи несвоевременного оперативного вмешательства, неадекватного доступа к кавернозным телам и т.д. Все это диктует необходимость акцентировать внимание практикующих урологов и организаторов урологической помощи на клиническом случае тотального некроза кожи полового члена у пациента, оперированного по поводу перелома полового члена.
Клинический случай:
Пациент Н., 34 лет, самостоятельно обратился в приемное отделение ГКБ им. Д.Д. Плетнева с жалобами на выраженные боли в области полового члена, почернение и частичную отслойку его кожи.
Из анамнеза известно, что за две недели до обращения в клинику в одном из стационаров г. Москвы пациенту в связи с травматическим разрывом белочной оболочки полового члена («переломом» полового члена) в экстренном порядке была выполнена ревизия полового члена, эвакуация гематомы и ушивание белочной оболочки полового члена. Антибактериальная профилактика проводилась цефтриаксоном. На третьи сутки после операции пациент был выписан на амбулаторное лечение у уролога по месту жительства с рекомендациями по обработке послеоперационных швов раствором бриллиантового зеленого, эластичном бинтовании полового члена.
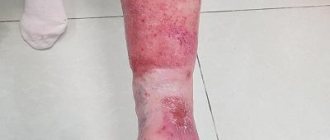
Однако через несколько суток после выписки пациент стал отмечать прогрессивно распространяющийся участок изменения цвета и консистенции кожи дистально от линии шва, который в свою очередь располагался вблизи корня полового члена. С течением времени кожа приобрела бурую, местами почти черную окраску с образованием участков изъязвлений (рис.1). Указанные изменения сопровождались интенсивными болями, что потребовало обращения за экстренной урологической помощью в ГКБ им. Д.Д. Плетнева.
Рис.1. Больной Н. Общий вид полового члена перед операцией. Видны участки некроза кожи, кожный дефект в области расхождения послеоперационного шва
При осмотре половой член в состоянии детуменесценции. Видна линия циркулярного послеоперационного шва отступя 2 см от корня полового члена. Дистальнее линии шва имеются участки некроза кожи с формированием трофических изъязвлений. Признаков инфекционно-воспалительного процесса (флегмоны полового члена, кавернита и т.д.) не наблюдалось.
После общеклинического обследования, не выявившего у пациента сопутствующих заболеваний, была выполнена хирургическая ревизия полового члена, некрэктомия (рис. 2) и первый этап операции Сапожкова-Райха — погружение полового члена в мошонку (рис. 3,4,5).
Рис.2. Больной Н. Произведена ревизия полового члена, некрэктомия. Сформирован подкожный канал в мошонке по средней линии. Намечено отверстие для выведения головки полового члена
Рис.3. Больной Н. Сформированный подкожный канал на мошонке
Рис.4. Больной Н. Половой член проведен по подкожному каналу мошонки, головка выведена наружу
Рис.5. Больной Н. Послеоперационная рана ушита узловым швом
Проводилась антибактериальная профилактика амоксициллином/ клавуланатом. Инфекционно-воспалительных осложнений не наблюдалось. На третьи сутки послеоперационного периода пациент в удовлетворительном состоянии был выписан под наблюдение урологом по месту жительства. Швы были сняты амбулаторно на десятые сутки послеоперационного периода.
Спустя 3 месяца пациент Н. повторно госпитализирован в ГКБ им. Д.Д. Плетнева в плановом порядке для выполнения второго этапа операции Сапожкова-Райха.
На момент госпитализации пациент предъявлял жалобы на косметический дефект и невозможность проведения полового акта. При осмотре было отмечено, что кожа мошонки растянулась, и имелся достаточный запас тканей для пластической операции. Пациенту выполнен второй этап операции Сапожкова-Райха. Проводилась антибактериальная профилактика амоксициллином/клавуланатом. Инфекционно-воспалительных осложнений не наблюдалось. На пятые сутки пациент в удовлетворительном состоянии выписан под наблюдение урологом по месту жительства с рекомендациями о половом покое на протяжении одного месяца.
ОБСУЖДЕНИЕ
В плане обсуждения целесообразно проанализировать каждый этап лечебно-диагностического процесса с позиции разумной достаточности.
Пациент с явной клинической картиной травматического разрыва белочной оболочки («перелома») полового члена экстренно поступает в урологическое отделение одного из городских стационаров, где его немедленно оперируют. На данном этапе все правильно: современная урология рекомендует максимально активную оперативную тактику при этом виде травмы. Даже если бы полный разрыв белочной оболочки не подтвердился (то есть «перелом» был бы признан ложным), выбор в пользу немедленной ревизии полового члена стоит признать верным.
Доступ к белочной оболочке и кавернозным телам хирург осуществлял посредством проксимального циркулярного доступа. Это решение представляется нам сомнительным по причине неучета особенностей кровоснабжения полового члена. Осевое продольное кровоснабжение органа предполагает использование циркулярного парагландулярного доступа, при котором риск пересечения крупных сосудов, а, значит, и ишемических осложнений минимален. Наоборот, разрезы, нанесенные вблизи корня полового члена, несут риск развития ишемии дистальной части органа. Этот риск и реализовался.
При повторном обращении за урологической помощью у пациента имелись показания к ревизии полового члена с некрэктомией. Однако было очевидным отсутствие достаточного количества неизмененной кожи для укрытия полового члена после выполнения некрэктомии. Имелись две альтернативы: открытое ведение послеоперационной раны в надежде на самостоятельное закрытие кожного дефекта и замещение кожного дефекта гетеротопическим кожным лоскутом.
Открытое ведение обширной раны полового члена сопряжено со значительными сроками реабилитации пациента, высоким риском формирования грубых рубцов и деформации полового члена. При этом пациент может испытывать значительный дискомфорт при эрекции. На наш взгляд, открытое ведение в современных условиях показано только при наличии инфекционного процесса в ране полового члена.
Замещение кожного дефекта гетеротопическим кожным лоскутом по методике Сапожкова-Райха проводится в два этапа, первым из которых является погружение полового члена в мошонку. Этим предотвращаются и инфекционно-воспалительные процессы в ране полового члена, и рубцовые деформации. Вторым этапом из тканей мошонки формируется кожный покров полового члена. Данная методика сравнительно проста в исполнении, не требует специальных микрохирургических навыков и оборудования и может быть выполнена в любом урологическом стационаре. Значимым противопоказанием к операции Сапожкова-Райха является инфекционный процесс в ране полового члена. В нашем наблюдении, несмотря на обширные очаги некроза, признаков раневой инфекции не было, что и обусловило выбор данной методики.
В дальнейшем пациенту удалось полностью восстановить функциональность органа без деформаций и косметических дефектов.
Несколько слов об антибактериальной профилактике. Если нет нарушения целостности мочевых путей, то целью антибактериальной профилактики становится предотвращение нагноения послеоперационной раны [7]. Наиболее частыми возбудителями раневой инфекции являются грамположительные кокки — негоспитальные штаммы Staphylococcus spp., реже Streptococcus spp. Поэтому препаратами выбора являются цефалоспорины I-II поколения и ингибиторзащищенные аминопенициллины. Если же у больного имеется открытая рана, в той или иной мере загрязненная, то предпочтение должно быть отдано ингибиторзащищенным аминопенициллинам, так как они способны предотвратить размножение не только характерной для данной ситуации грамположительной флоры, но и анаэробных возбудителей.
У настоящего пациента антибактериальная профилактика первоначально проводилась цефалоспорином III поколения. Препарат имеет высокую активность в отношении негоспитальных грамотрицательных палочек — характерных возбудителей неспецифических инфекционно-воспалительных заболеваний органов мочеполовой системы [8]. Но в изучаемой ситуации эти возбудители малоактуальны, так как непосредственно мочевые пути не были травмированы. Актуален стафилококк. Антистафилококковая активность цефтриаксона невысока, хотя и считается клинически значимой. Выбор этого препарата полностью ошибочным признать нельзя, правильнее сказать, что он не является лучшим в изучаемой ситуации.
В дальнейшем назначен был амоксициллин/клавуланат, который продемонстрировал наиболее высокую эффективность в режиме антибактериальной профилактики при оперативных вмешательствах на половом члене [9].
ЗАКЛЮЧЕНИЕ
Описанный случай, на наш взгляд, не является следствием стечения неблагоприятных обстоятельств. Это чисто ятрогенное осложнение, очевидно предотвратимое при технически верном выполнении оперативного доступа к кавернозным телам. Это следствие недостаточной подготовки хирурга, причем подготовки теоретической.
В современных условиях такие осложнения чреваты жалобами в надзорные организации, финансовыми претензиями со стороны страховых компаний, а также судебными исками. В данном случае пациенту удалось полностью вернуть эректильную функцию, и никаких претензий с его стороны не имелось.
Но не все риски реализовались. В условиях значительного объема ишемизированных и некротизированных тканей в любой момент может присоединиться инфекционный процесс. При отсутствии своевременной помощи это практически неизбежно. Учитывая выраженность и распространенность поражения, можно допустить, что пациент успел обратиться за 1-2 суток до развития инфекционно-воспалительного процесса. А если бы он оказался более терпеливым и появился бы в урологической клинике с флегмоной полового члена, или, того хуже, с признаками бактерио-токсического шока? (Острый кавернит и флегмона полового члена отличаются крайне агрессивным течением и часто осложняются бактериотоксическим шоком). Тогда ни о каком сохранении эректильной функции речь бы уже ни шла. Обсуждался бы вопрос об уровне ампутации органа. Административные и/или финансовые издержки для ЛПУ при таком повороте событий высоковероятны.
В завершение еще раз подчеркнем: доступ к кавернозным телам — парагландулярный с последующей дегловацией полового члена; необходимость отказа от такого доступа должна быть четко обоснована. Например, при очень проксимальных дефектах белочной оболочки вышеописанный доступ может оказаться неудобным, тогда имеются два варианта: продольный разрезом в проекции дефекта (хирург должен четко представлять локализацию повреждения, что не всегда возможно) или трансскротально с вывихиванием полового члена в рану, что более травматично, но позволяет осуществить ревизию органа.
ЛИТЕРАТУРА
1. Максимов В.А., Яровой С.К., Хромов Р.А., Прохоров А.В., Странадко М.В. Состояние и перспективы развития службы экстренной андрологической помощи в Москве. Урология 2012;(1):72-76.
2. Яровой С.К., Хромов Р.А., Дзидзария А.Г., Прохоров А.В. Вопросы ургентной андрологии. Москва. Уромедиа. 2016. 120с.
3. Урология. Национальное руководство [Под редакцией Лопаткина Н.А.]. Москва. ГЭОТАР-Медиа. 2009. 1021с.
4. Muentener M, Suter S, Hauri D, Sulser T. Long-term experience with surgical and conservative treatment of penile fracture. J Urol 2004;172(2):576-579.
5. Athar Z, Chalise PR, Sharma UK, Gyawali PR, Shrestha GK, Joshi BR. Penile fracture at Tribhuvan University Teaching Hospital: a retrospective analysis. Nepal Med Coll J 2010 Jun;12(2):66-8.
6. Mydlo JH. Surgeon experience with penile fracture. J Urol 2001;166:526-529.
7. Максимов В.А., Яровой С.К., Странадко М.В., Мисякова О.А. Эмпирическая антибактериальная профилактика в урологии. Экспериментальная и клиническая урология 2012;(1):76-84.
8. Справочник по антимикробной терапии [Под редакцией Козлова Р.С., Дехнича А.В.]. Смоленск. МАКМАХ. 2010. 416с.
9. Яровой С.К., Хромов Р.А. Тактика экстренной урологической помощи при ишемическом приапизме. Лечащий врач 2014;(1):46-49.
| Attachment | Size |
| 540.36 KB |
‹ Неврологические расстройства при хронической болезни почек Оксидативный стресс и патозооспермия ›
6.5. Врождённое варусное положение шейки бедренной кости
Врождённое варусное положение шейки бедренной кости называют также варусным положением шейки бедренной кости в связи с задержкой в развитии. При этом походка напоминает ходьбу человека с врождённым вывихом бедра. На рентгенограмме видно, что характерными признаками этого заболевания являются: уменьшение шеечно-диафизарного угла, недостаток кальция в нижней части шейки бедренной кости и образование треугольной кости.
Механизм и причины этого заболевания неясны. Считается, что они связаны с врождённым ненормальным развитием эпифизарной пластинки и с помехами в процессе кальцификации внутри шейки бедренной кости.
6.6. Красная волчанка
Hebra (1854) описал красную волчанку, которая главным образом располагалась на лице, щеках и носу в виде бабочки. Cazenave (1851) предложил называть эту болезнь красной волчанкой (lupus erythematosus), возможно, это была дискоидная красная волчанка. Kaposi (1872) использовал это название для различения только проявлений по- вреждения кожи, но не повреждений внутренних органов. Osler (1895—1904), назвав это заболевание экссудативной эритемой, описал различные проявления системной красной волчанки во внутренних органах. Libman и Sack (1924) назвали данную болезнь неревматическим бородавчатым эндокардитом. Baehr (1935) представил материалы вскрытия 23 больных, выдвинув идею о вреде солнечного облучения при этой болезни, а также описал гломерулонефрит, который имел вид «золотых витков нитей».
Нагgгаvе (1948) экстракцией костного мозга впервые доказал клеточную природу волчанки. Miescher и Fauconnet (1956), наблюдая факторы роста клеток красной волчанки, которые поглощались сывороткой крови при их контакте с изолированными ядрами клеток, предположили, что клеточные факторы волчанки представляют собой антинуклеарные антитела. Friou (1958) сообщил об использовании флюоресцирующих античеловеческих глобулинов для обнаружения антинуклеарных антител. Klemperer (1942), изучив системную красную волчанку и дерматосклероз, предложил называть их диффузным коллоидным заболеванием. Несмотря на то, что в научных кругах по-прежнему спорят о сущности этих болезней, понятие «коллоидное заболевание» всеми было принято очень быстро. В 1952 г. Ehrlich предложил термин «заболевания соединительной ткани», который постепенно вытеснил прежнее название.
Системная красная волчанка (Systemic lupus erythematosus) представляет собой множественное аутогенное аутоиммунное заболевание, затрагивающее многие системы и органы. Механизм данного заболевания главным образом состоит в осаждении иммунных комплексов во всех внутренних органах, но точные причины болезни пока ещё полностью не объяснены.
Системная красная волчанка вызывает АНГБК из-за осаждения иммунных комплексов. Она активизирует комплементы и порождает активные медиаторы, проникающие в костные ткани (трабекулы, сетчатые структуры костного мозга, микрокапилляры внутри кости) и разрушает их, изменяя вязкость и реологию крови, образуя тромбы. В результате этого, в головке бедренной кости возникает остеолитический некроз, затрагивающий также вертлужную впадину и ветви седалищной кости.
Основные патологические изменения при красной волчанке заключаются в возникновении слизеподобных отёков и фибриноидной дегенерации соединительной ткани, а также некротического васкулита. Особо следует отметить, что когда больные красной волчанкой принимают стероидные гормоны, то после такого лечения заболеваемость АНГБК резко возрастает.
Системная красная волчанка в сочетании с некрозом головки бедренной кости возникает, во-первых, вследствие того, что она непосредственно вызывает этот некроз; во-вторых, потому, что после приёма стероидных гормонов в структуре головки бедренной кости происходит дегенерация, повреждаются сетчатая структура трабекул, костного мозга и микрокапилляры внутри кости, гипертрофируются жировые клетки внутри кости, сдавливаются внутрикостные микрокапилляры в зоне наибольшей нагрузки головки бедренной кости, прекращается поступление питания в кость, и, в конечном итоге, происходит коллапс головки бедренной кости.
Местные осложнения
В зоне операционной раны могут возникнуть следующие неприятности:
- кровотечение из-за нарушения свёртываемости крови, соскальзывания шовного материала с сосуда или недостаточного восстановления гемостаза в ходе операции. Для устранения кровотечения накладывают швы, делают повторное лигирование, помещают холод на рану или вводят гемостатические препараты;
- гематома из-за кровоточащего сосуда. Гематому вскрывают, удаляют пункцией. При небольших размерах она рассасывается при УФО или наложении компресса;
- инфильтрат — отёк тканей в пределах 10 см от краёв шва вследствие инфицирования раны или образования некроза в подкожно-жировой клетчатке. В зависимости от причины для его рассасывания применяются физиотерапевтические процедуры или хирургическая обработка;
- нагноение ― инфильтрат с выраженным воспалением. Чтобы ликвидировать его, снимают швы, раскрывают края раны, промывают и устанавливают дренаж;
- эвентрация ― выпадение внутренних органов наружу из-за нагноения, непрочного ушивания краев раны, увеличения внутрибрюшного давления при кашле или метеоризме или сниженной регенерации (заживлении) тканей. Необходимо вправление органов с соблюдением асептики, строгий постельный режим и ношение тугого бандажа.
- Лигатурный свищ ― возникает при образовании абсцесса вокруг шовного материала. Требуется его иссечение вместе с шовным материалом.
6.7. Метаболические заболевания кости
Скелет, являясь не только важной опорой тела человека, но и самым большим костным депо минералов, на которое опирается тело человека, защищает сердце, головной мозг, лёгкие и кровеносную систему. Он играет важную роль в регуляции минерального баланса в организме человека и обмене веществ. Клетки костных тканей очень активны, они непрерывно обновляются, в них постоянно происходит обмен веществ. Деятельность костной ткани подвергается влиянию многочисленных гормонов, из которых самые важные — гормоны паращитовидной железы: парагормон и кальцитонин.
Метаболические болезни кости обычно проявляются костной болью, деформацией, патологическим переломом и патологическими изменениями мышц.
Метаболические заболевания кости главным образом включают: аномальную абсорбцию кости, аномальный остеогенез и аномальное осаждение минералов в кости. В общем, под метаболическими заболеваниями кости понимают нарушение не только минерального обмена веществ или обмена веществ в костном матриксе, вызванное разными причинами, но и биохимические и морфологические изменения в костной ткани, выражающиеся в ряде болезненных и физических симптомов. Причин возникновения метаболических заболеваний кости много, у учёных нет единого мнения по этому вопросу. Ниже представлена часть метаболических заболеваний, связанных с АНГБК:
• костные болезни, вызванные расстройством функции эндокринных желёз; • костные болезни, вызванные нарушением питания; • почечные костные болезни; • конверсионные костные болезни (например, деформи- рующий остит, гиперфосфотазная болезнь); • костные болезни вызванные медикаментами и химиче- скими веществами; • осаждение кальция на кости; • костная опухоль как результат осложнения метаболиче- ского заболевания кости; • несовершенный остеогенез, остеосклероз; • ахондроплазия, остеодисплазия; • первичная и вторичная гиперфункция щитовидной же- лезы; • старческая костная атрофия как результат аменореи. Вышеперечисленные заболевания могут в разной степени создавать разрушения головки бедренной кости, приводящие к АНГБК.
6.8. Нейротрофические заболевания костей и суставов
Нейротрофические заболевания костей и суставов называют также суставом Шарко (нейрогенная артропатия). Нейтрофическая артропатия Шарко представляет собой своеобразное дегенеративно-дистрофическое поражение суставов, обусловленное нарушением их иннервации. Это заболевание могут вызвать следующие причины: • поражения спинного мозга при сирингомиелии, третичном сифилисе (нейролюэс), В12 дефицитной анемии (фуникулярный миелоз), миеломенингоцеле, опухоли «конского хвоста»; • патология периферических нервов при декомпенсированном инсулинзависимом сахарном диабете, хроническом алкоголизме, дефиците витамина В1 (берибери), проказе, семейной амилоидной нейропатии.
В основе артропатии Шарко лежат нарушения трофики и чувствительности денервированных суставных тканей. Ослабление трофически изменённого сухожильно-связочного аппарата приводит к нестабильности суставов, что в условиях снижения глубокой (проприоцептивной) и болевой чувствительности способствует их повышенной травматизации. Более того, вследствие трофических нарушений в костной ткани даже обычная нагрузка на суставы становится чрезмерной. Под влиянием указанных факторов возникают выраженные деструктивные изменения в суставах, в частности развитие остеолитических процессов в эпифизах с их фрагментацией и образованием внутрисуставных костно-хрящевых секвестров. Рентгенограммы тазобедренного сустава при данном заболевании свидетельствуют о наличии остеопороза и разрушении костной структуры, рассасывании головки бедренной кости, а в тяжёлых случаях — о рассасывании и исчезновении головки и шейки бедренной кости. В суставе есть только небольшое количество костно-хрящевых образований (костных остатков), повреждённый конец шейки бедренной кости вывихнут вверх, вертлужная впадина и остатки шейки бедренной кости выглядят неясно, плотность кости снижена. На некоторых снимках головка бедренной кости плоская, а шейка укороченная, плотность кости повышенная, между головкой бедренной кости и вертелом есть рассеянные мешкообразные светопроницаемые зоны и периферический склероз. Края вертлужной впадины утолщены и окостенели, расстояние между головкой бедренной кости и дном вертлужной впадины расширено, головка бедренной кости сдвинута наружу, суставное пространство заметно сужено, под большим вертелом имеется широкая пролиферация надкостницы в виде луковой шелухи, в тканях хряща на верхнем конце берцовой кости есть длинная полоса кальцификации (кальцификация широкой фасции), а в нижней части седалищного бугра — кальцификация в виде полосы или круга.
Дифференциальные признаки сустава Шарко.
Сустав Шарко отличается от остеоартропатии главным образом тем, что он проявляется наличием остеопороза, разрушением сустава, наличием костных остатков внутри сустава и его деформации. При этом, главным является не столько остеопороз, сколько наличие одновременно с ним серьёзных разрушений сустава, что совершенно не согласуется с субъективными симптомами больного в виде лёгкой боли.
Выраженность остеопороза при остеоартропатии меньше, чем при суставе Шарко, и её главными симптомами являются боль в суставах и нарушение движения.
Лечение 3-4 стадий некроза
Если сустав уже перешел в эти стадии, то процесс разрушения головки бедра уже начался. ЛФК и физиотерапия остаются в том же ключе, что и при начальных стадиях, а медикаментозная терапия претерпевает изменения. Это связано с выраженным болевым синдромом, который пациенты уже не в силах терпеть. Назначают более сильные обезболивающие (диклофенак, трамадол).
Лечебное воздействие дополняют внутрисуставными инъекциями гиалуроновой кислоты и введение богатой тромбоцитами плазмы.
Гиалуроновая кислота – важный компонент синовиальной жидкости. Подобные инъекции улучшают амортизацию конгруэнтных поверхностей, облегчают их скольжение относительно друг друга.
PRP.
PRP-терапия (введение богатой тромбоцитами плазмы) активизирует процессы заживления. Это молодое, но перспективное направление. Под действием тромбоцитов усиливается выработка коллагена (основной «строительный материал» хрящевой, соединительной и костной ткани). Происходит интеграция остеобластов, помогающих строить новую ткань, улучшается микроциркуляция за счет образования новых сосудов.
Важно: несмотря на широту возможностей современной медицины, консервативной лечение эффективно только на ранних стадиях. При первых признаках разрушения головки сустав восстановлению не подлежит.
В этой ситуации будет приниматься решение о хирургическом вмешательстве. Основные сочетания групп оперативных методик [14]:
- межвертельная корригирующая остеотомия;
- моделирование головки бедренной кости, в том числе с межвертельной корригирующей остеотомией;
- моделирование головки бедренной кости с аутопластикой, в том числе с межвертельной корригирующей остеотомией;
- субхондральная аутопластика головки бедренной кости, в том числе с межвертельной корригирующей остеотомией;
- сегментарная аутопластика головки бедренной кости, в том числе с межвертельной корригирующей остеотомией;
- реконструкция тазовых компонентов, а именно: остеотомия таза по Хиари, в том числе с межвертельной корригирующей остеотомией, надвертлужная ацетабулопластика, в том числе с межвертельной корригирующей остеотомией.
Ни одна операция не гарантирует полноценного выздоровления. Они уменьшают деструктивные процессы внутри сустава и снижают риск развития вторичного коксартроза.